沙特MDMA注册概况
沙特SFDA是指沙特阿拉伯食品和药品管理局(Saudi Food and Drug Authority)。沙特SFDA是沙特阿拉伯政府的监管机构,负责管理和监督沙特阿拉伯境内的食品、药品、医疗器械和化妆品等产品的安全性和质量。医疗器械只有在向沙特食品和药品管理局(SFDA)注册并获得医疗器械市场授权(MDMA)后,才可以在沙特阿拉伯境内以有偿或免费的方式提供,并用于分销和/或使用。
自2022年9月27日起,SFDA已取消了MDMA GHTF申报路径,即原本医疗器械通过欧盟,美国,加拿大,澳大利亚,日本的认证或注册后便可完成审批的路径被取消。所有类别的医疗器械均应走MDMA(Medical Device Marketing Authorization)通道。不管是A类还是其他高风险类别的产品,均应符合MDMA的要求。
海外制造商应委派当地授权代表,由其代表制造商进行MDMA注册。通过该途径获得 MDMA 批准的 SFDA 医疗器械注册时间通常为 35 天,许可证有效期为原始许可证有效期或未定义的原始许可证有效期为 3 年。
沙特MDMA产品分类规则
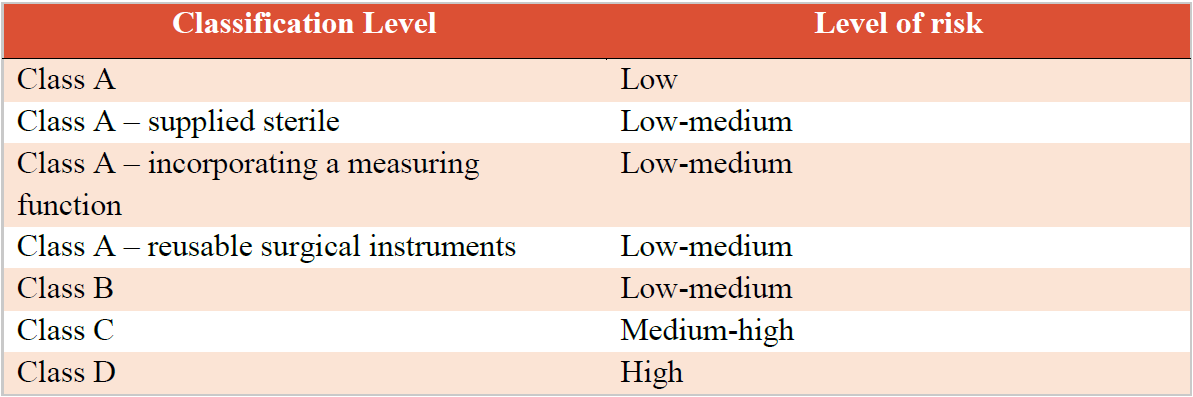
根据沙特医疗器械法规MDS-G008, 医疗器械产品(MD)和体外诊断产品(IVD)基本都是按照Class A, Class B, Class C和Class D进行划分。
制造商负责使用一套分类规则确定设备的分类,分类规则基于:
制造商对器械的预期用途
对患者、用户和其他人的风险水平(伤害发生的概率和伤害的严重程度)
对人体的侵入程度
使用期限
沙特MDMA基本注册流程:
1. 制造商根据MDS-REQ1En准备沙特MDMA注册所需的技术文档,且医疗器械制造商必须拥有符合 ISO 13485:2016标准的QM系统。
2. 在沙特阿拉伯当地没有营业地点的境外制造商需指定一名授权代表AR,授权代表需要通过"GHAD System"申请获得授权代表证书。
3. 通过 AR 提交医疗器械销售许可 (MDMA) 申请。此申请将包括:器械标签、eIFU 以及英语和阿拉伯语的宣传材料等等。它还需要包括参考市场的批准文件和英文认证。
4. 支付申请和评审费用
5. SFDA 审核申请,然后合格评定机构 (CAB) 对申请进行严格的技术审查。
6. CAB审核后,向 SFDA 提出建议,SFDA 将做出最终决定。如果获得批准,SFDA 将颁发 MDMA证书
7. SFDA负责维护在线医疗器械国家注册处 (MDNR)。该数据库列出了所有器械和位于沙特阿拉伯的公司。在器械投放市场之前,AR会提交相关信息并分配一个MDNR编号。
MDS-REQ1En提及的制造商需要准备的技术文档清单:
详细内容如下: