MR环境下,核磁共振成像设备产生的磁共振现象会对在此环境下的患者和人员产生一定的风险。
因此医疗器械制造商应在医疗器械风险管理中考虑植入物或预期进入MR环境的医疗设备的安全性和有效性。
上期我们介绍了ASTM F2503中医疗器械在磁共振环境中的安全标记,这期我们一起梳理一下不同国家要求指南和测试评估内容。
01 FDA注册要求
1.磁共振(MR)环境中医疗器械的安全检测和标记指南
(Testing and Labeling Medical Devices for Safety in the Mag-netic Resonance (MR) Enviro-nment)
发布时间:
2021年5月20日,该指南草案在2019年8月已发布,正式稿取代了 2014年发布的“Establishing Safety and Com-patibility of Passive Implants in the Magnetic Resonance (MR) Environment”指南文件。
适用范围:
本指导文件适用于可能在MR环境中使用的所有医疗设备。这包括所有植入的医疗设备、固定在病人身上或由病人携带的医疗设备(例如,外部胰岛素泵、脉搏血氧计)、在临床护理期间合理预计将进入MR环境的医疗设备,以及打算进入MR环境的所有医疗设备。
概述
该指南分析了有关MR环境下医疗器械可能产生的危害,并提出了控制措施和验证要求,此外提出了MR环境下的安全标记。
2.ISO\TS 10974 Second edi-tion 2018 -Assessment of the safety of magnetic resonance imaging for patients with an active implantable medical device
发布时间:
2018年6月7日
适用范围:
该指导文件适用于有源植入式的医疗器械,植入该器械的患者拟在磁场强度在1.5T,圆柱形孔内进行磁共振扫描。
概述:
该指南是对MR环境下有源植入式的医疗器械(AIMD)控制与验证要求,以及随附信息的说明。
3.测试标准
磁致位移力试验方法:
ASTM F2052 Standard Test Meth-od for Measurement of Magnetic-ally Induced Displacement Force on Medical Devices in the Magn-etic Resonance Env-ironment.
图像伪影评价方法:
ASTM F2119 Standard Test Meth-od for Evaluation of MR Image Artifacts from Passive Implants.
射频制热试验方法:
ASTM F2182 Standard Test Meth-od for Measurement of Radio Fre-quency Induced Heating on or Ne-ar Passive Implants During Mag-netic Resonance Imaging.
磁致扭矩试验方法:
ASTM F2213 Standard Test Meth-od for Measurement of Magnetic-ally Induced Torque on Medical Devices in the Magnetic Reson-ance Environment.
安全标记:
ASTM F2503 Stand-ard Practice for Marking Me-dical Devices and Other Items for Safety in the Ma-gnetic Resonance Environment.
02 CE注册要求
1、Regulation (EU) 2017/745
根据 Regulation (EU) 2017/745 附录I General safety and performan-ce requirements
条款14.2(b)要求
“医疗器械的设计和制造应尽可能地消除或减少-(b) 与合理可预见的外部影响或环境条件有关的风险,如磁场、外部电和电磁效应、静电放电、与诊断或治疗程序有关的辐射、压力、湿度、温度、压力和加速度的变化或无线电信号的干扰” 预期或可能进入MR环境下的医疗器械应该识别与环境条件有关的风险 并尽可能的消除或减少。
条款23.4.(s)要求
“有关允许向使用者和/或患者通知任何警戒、预防措施、禁忌症、待采取措施以及与器械有关的使用限制信息。在相关情况下,此信息应允许使用者向患者简述所有警戒、预防措施、禁忌症、待采取措施以及与器械有关的使用限制。该信息应酌情包括 -警戒、预防措施和/或就暴露于合理可预见的外部影响或环境条件采取的措施(例如磁场、外部电和电磁效应、静电放电、与诊断或治疗过程相关的辐射、压力、湿度、或温”预期或可能进入MR环境下的医疗器械应向使用者说明器械有关的使用限制信息。
2、EN ISO 14630:2012 Non-active surgical implants— Ge-neral requirements
条款5 n)Design attributes
满足预期性能的设计属性至少应考虑辐射、电磁和磁场对植入物及其功能的影响,以及由此对身体的任何影响。(特别值得注意的是磁共振成像(MRI)在患者安全方面的应用领域。
ASTM F2052, ASTM F2119, ASTM F2182和ASTM F2213中的测试方法可以用来评估植入物在MR环境中的安全性)
条款11.3 r) Instructions for use
一份关于植入物在MR环境中的安全性的声明,以及在适当情况下关于MR图像伪影的信息,以帮助医生理解植入物在MR图像中产生的失真和信号丢失。
3.测试标准
磁致位移力试验方法:
ASTM F2052 Standard Test Meth-od for Measurement of Magnetic-ally Induced Displacement Force on Medical Devices in the Magn-etic Resonance Env-ironment.
图像伪影评价方法:
ASTM F2119 Standard Test Meth-od for Evaluation of MR Image Artifacts from Passive Implants.
射频制热试验方法:
ASTM F2182 Standard Test Meth-od for Measurement of Radio Fre-quency Induced Heating on or Ne-ar Passive Implants During Mag-netic Resonance Imaging.
磁致扭矩试验方法:
ASTM F2213 Standard Test Meth-od for Measurement of Magnetic-ally Induced Torque on Medical Devices in the Magnetic Reson-ance Environment.
安全标记:
ASTM F2503 Stand-ard Practice for Marking Me-dical Devices and Other Items for Safety in the Ma-gnetic Resonance Environment.
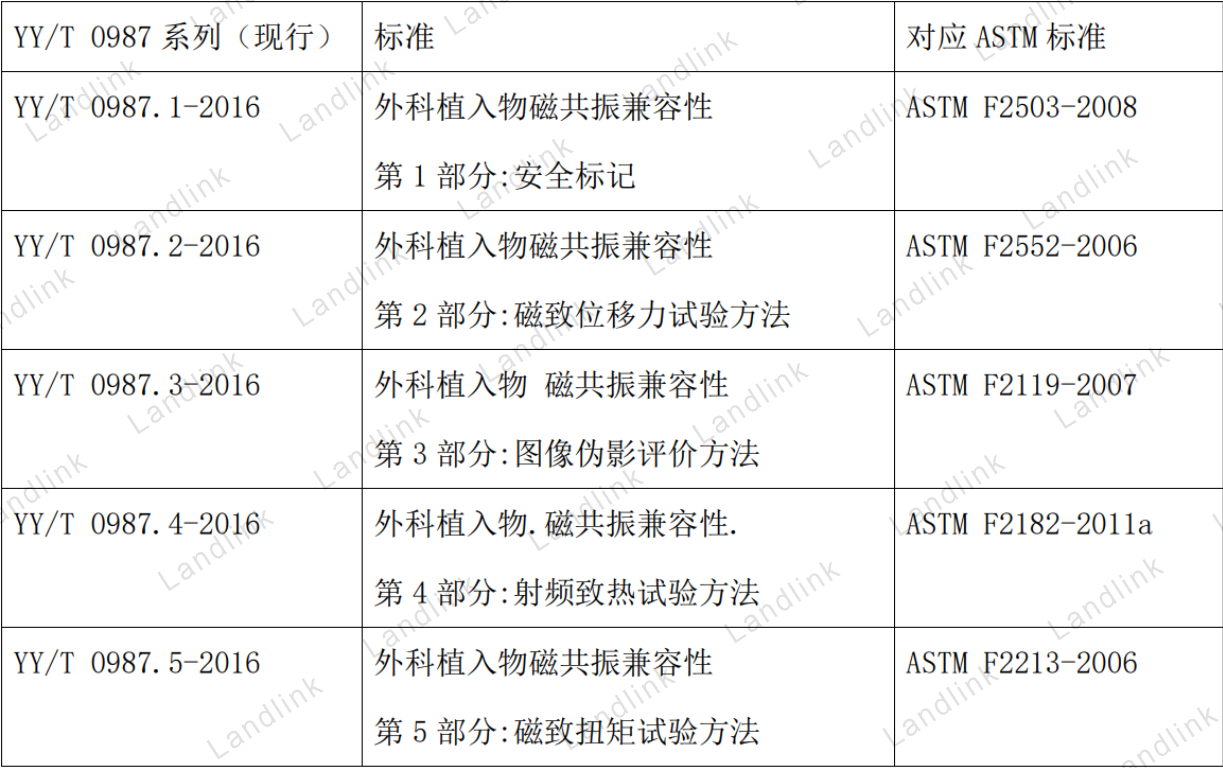
我国主要参考ASTM制定的系列标准合理转换为我国自己的标准,目前评价和检测的重点仍限于无源外科植入物为主。
我国YY/T 0987系列标准和美国ASTM的系列标准对应关系如下表所示: