2021年12月20日, 欧洲议会和理事会宣布通过了一项修正案——体外诊断医疗器械法规 (IVDR) 于从2022年5月26日逐步推出的提案已正式生效。该修正案规定了不同类别的IVD器械可以推迟到相应的适用日期。修订后的法规不会改变2017 年原始体外诊断法规(IVDR)的任何要求。
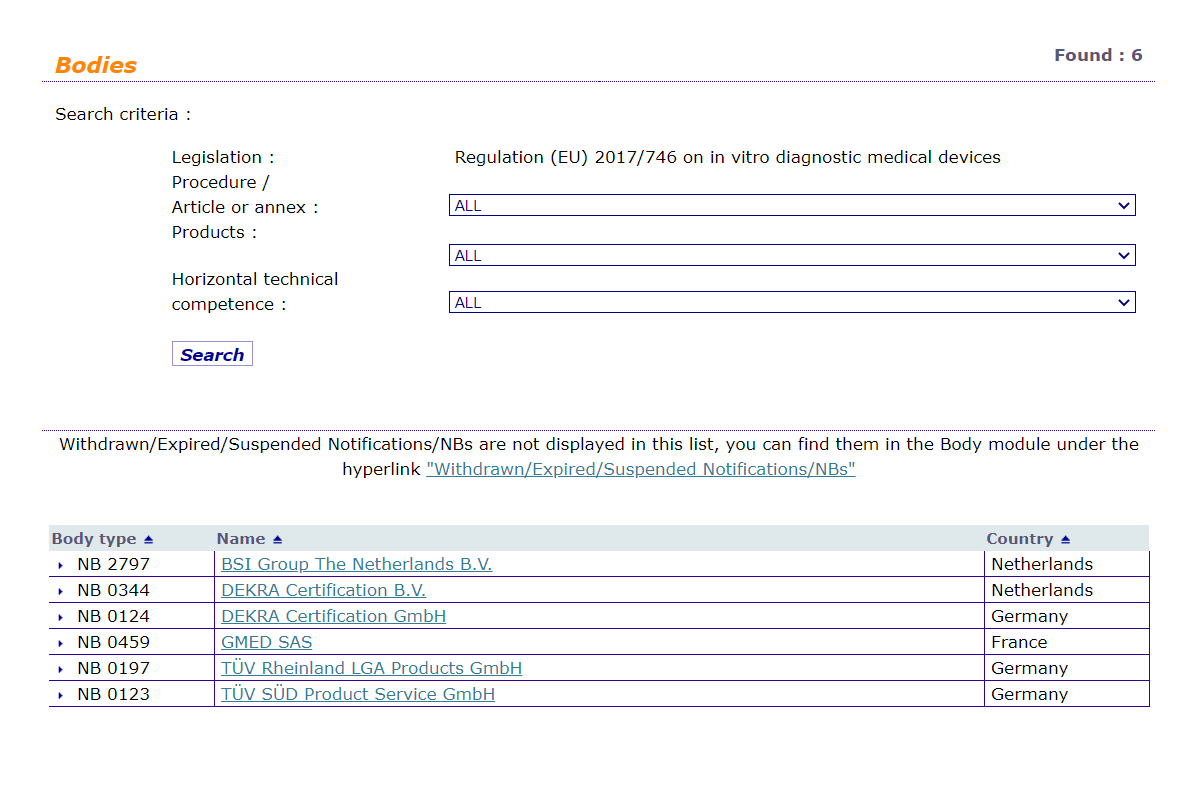
虽然该修正案一定程度上缓解了IVDR认证的审核压力,但截至目前,只有6家公告机构拥有审核IVDR的资质。欧盟官方提醒IVDR制造商,称审核IVDR的公告机构仍处于超负荷运行的状态,这些公告机构将在未来几年完成大量的审核工作。
欧盟对于该问题也进行了进一步的努力,希望通过增加IVDR公告机构的方式缓解认证压力。但截至2021年12月中旬,除已获得资质的 6 个公告机构外,还没有任何公告机构达到接收最终报告的阶段。最终报告是申请IVDR公告机构资质的 11 步流程中的第7步。
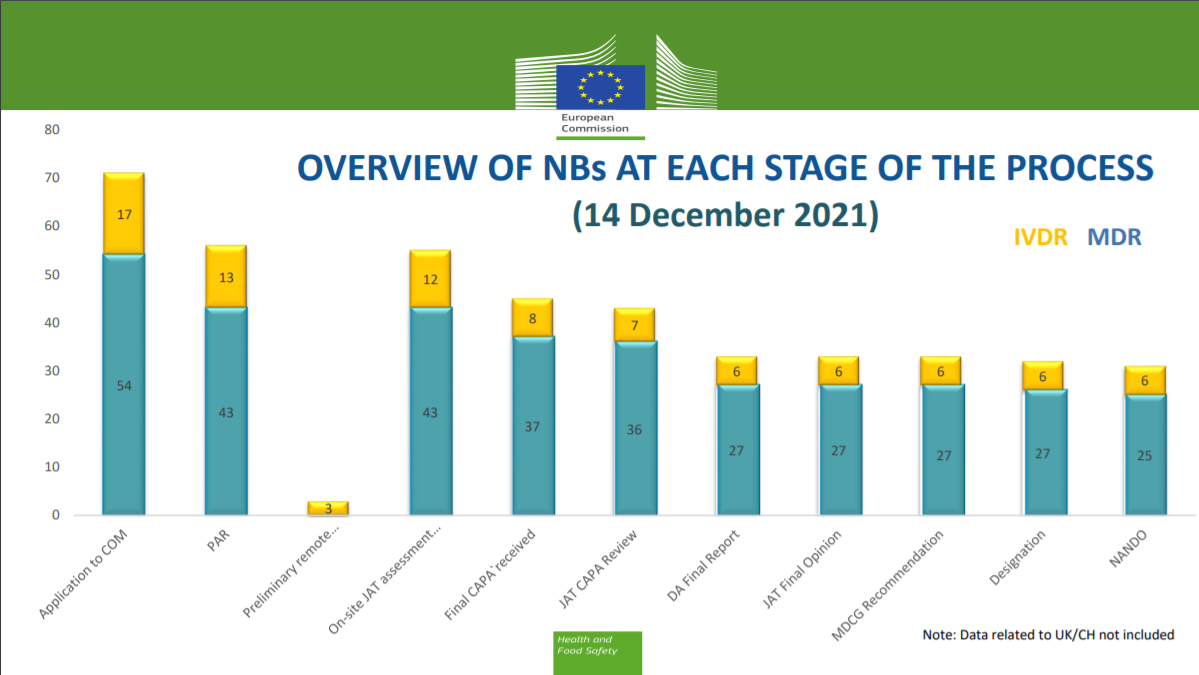
由于已有 17 家公告机构申请了 IVDR 资质,在未来欧盟可能会拥有超过20家拥有IVDR审批资质的公告机构。尽管从长远来看这是个好兆头,但尚不清楚这些IVDR审批公告机构是否会及时上线,以应对由 IVDR 分批推迟审核所引发的一波又一波的合格评定。
从与公告机构签订合同,完成认证工作并将IVD产品交付给医院、临床实验室和患者,总共需要 12-24 个月。此外,还有大量的IVD制造商处于观望状态,并未及时申请IVDR认证。从目前的情况来看,在每个推迟审核批次的末期,将有大量的IVD制造商集中申请审批,这将给为数不多的IVDR公告机构带来巨大的审批压力。而IVD审批的不及时问题也将使欧盟在未来会陷入相关IVD器械短缺的情况。
为此,在今年的第一份指南MDCG2022-1中,欧盟官方也呼吁制造商,如果制造商在未来希望按IVDR将产品投放市场,即使目前IVDD的认证还未到期,也应尽早申请IVDR的审批,以降低IVDR审核在时间上的不平衡性,保证其能够在欧盟及时地供给足量的体外诊断器械。



