01 法规背景
2022年1月28日,OJ上正式发布IVDR过渡期调整的法规Regulation (EU) 2022/112。调整后,很多产品可以享受过渡期延期。

根据IVDR第110条第3款要求,进行延期的条件是器械的设计和预期用途不能发生重大变更。
2022年5月4日,欧盟发布了“MDCG 2022-6 Guidance on significant changes regarding the transitional provision under Article 110(3) of the IVDR”,为制造商和公告机构进一步明确什么样的变更属于重大变更。
02变更内容
让我们先来看看下图,一般有哪些变更?
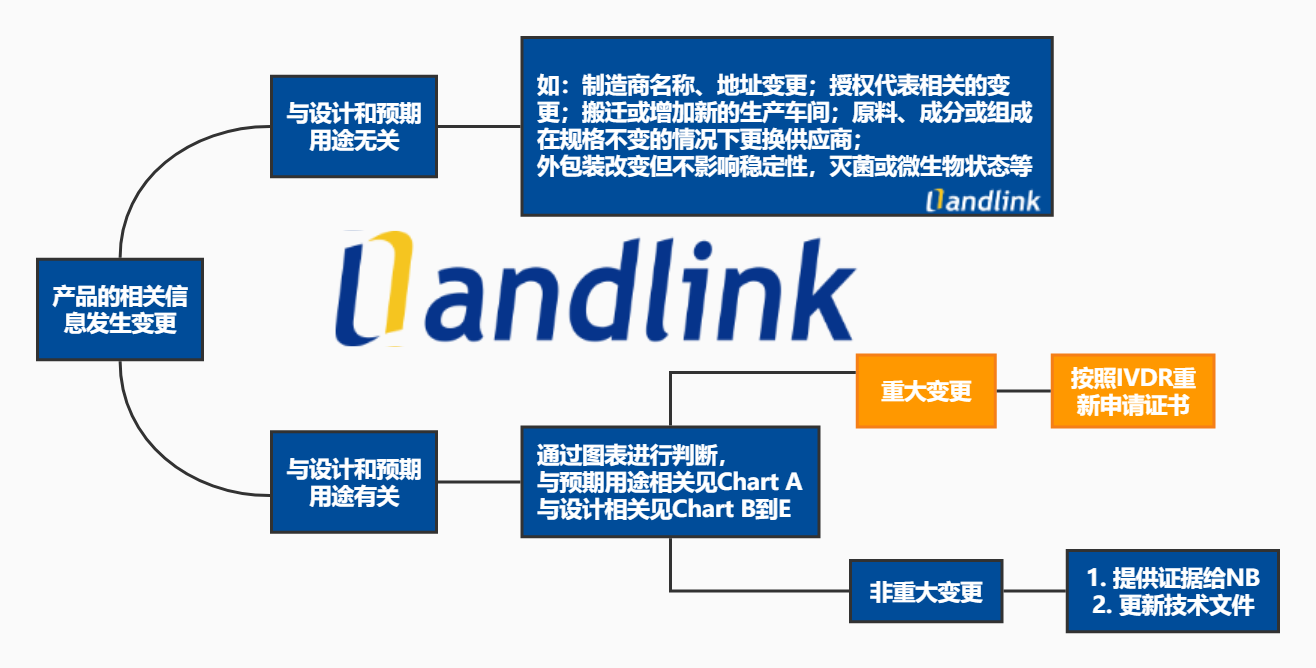
产品的变更,首先判断这些变更与设计或预期用途是否相关,若无关,可判定为非重大变更,若变更与设计或预期用途相关,那么制造商可以很好的利用MDCG 2022-06附录中这几个图表(图表A-E),帮助判断是否为重大变更。小编建议可以在更新程序文件的时候把图表加进去。对,看过指南的您赶紧去升级相关的程序文件吧!小编已经帮您把流程图都整理好了,拿走不谢。
流程图①:预期用途的变更
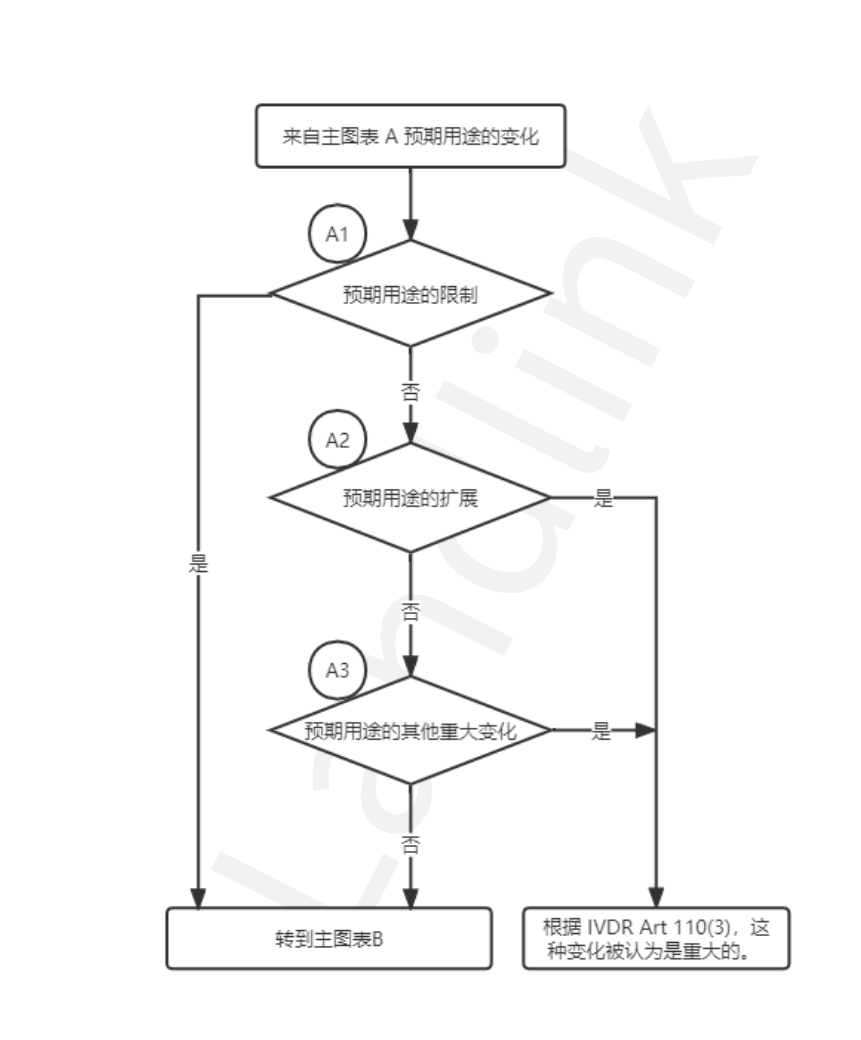
Note: 在图表A中提到的“预期用途的限制”,是指对目标人群,样本类型,采样部位的限制。
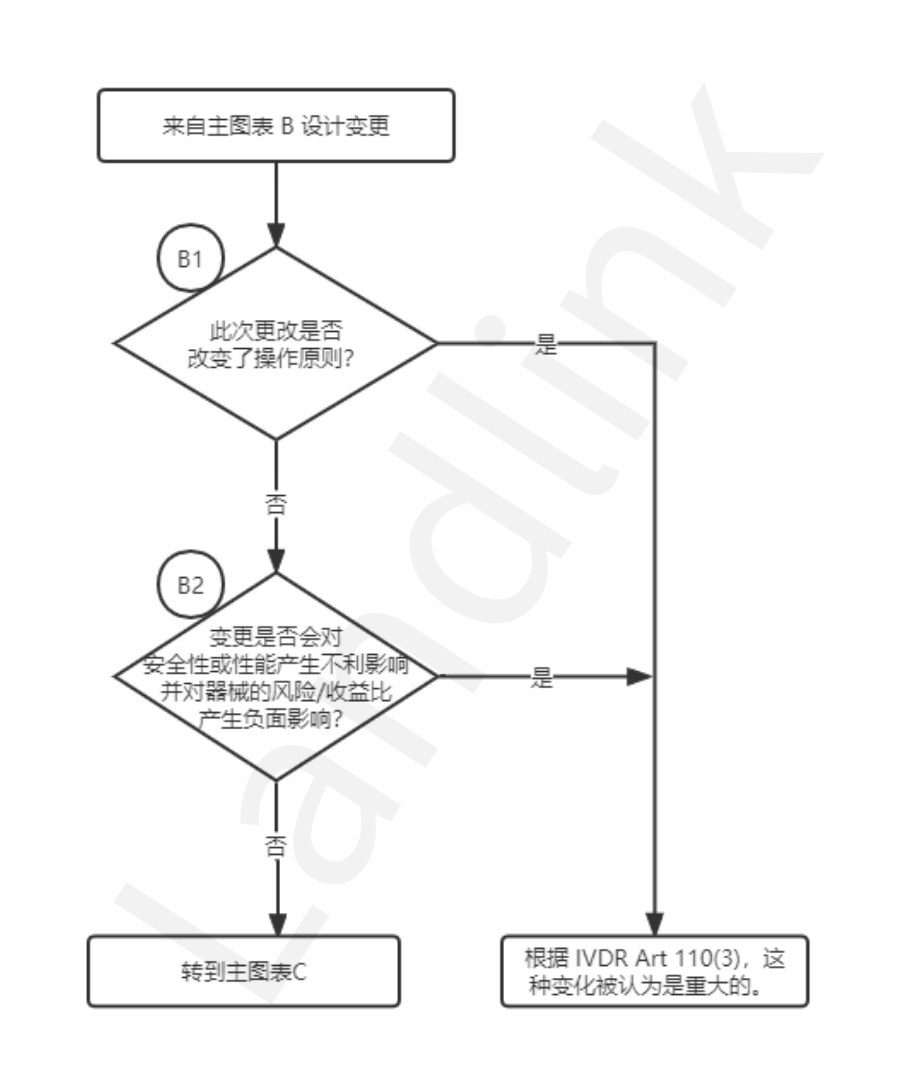
流程图②:设计变更
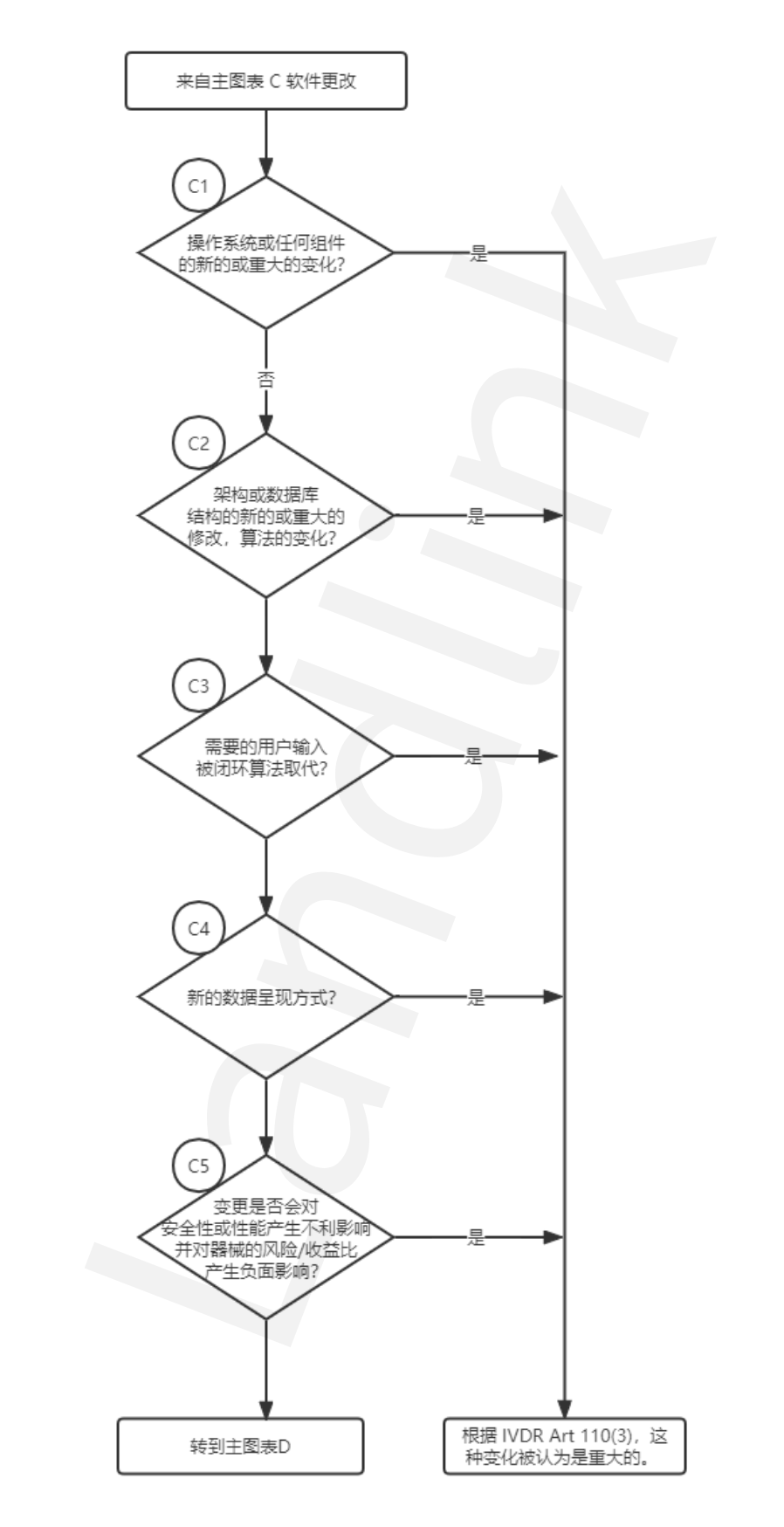
流程图③:软件变更
流程图④:成分或材料的变更

流程图⑤:器械或包装设计的灭菌方法变更

03 小结
不要谈变更就色变,在不影响证书享受过渡期延期的情况下,制造商该变还得变。注意的就是,您要准备好相关的证据,更新相应的资料并通知您的公告机构。
04 IVDR技术服务支持
Landlink拥有丰富的IVDR产品项目经验,专业的IVDR法规老师和技术团队可为您量身打造以下服务:
IVDR注册服务
IVDR技术文件编写
IVDR质量体系合规服务
企业SRN申请和IVDR产品注册



