01FDA新增突破性器械专栏
2018年12月,FDA官网发布了突破性器械计划(Breakthrough Device Program)的指导文件,该途径为某些有前途的器械提供加速审查,包括在上市前过程中与机构工作人员的额外联系和优先审查。
本月, FDA 发布了一个专门介绍该计划的新网页,内容涵盖突破性计划常见问题解答、显示每年接受进入该计划的器械数据以及通过突破性计划获得的授权器械的完整列表。数据显示,神经病学和心血管器械最有可能被突破性器械途径接受并获准进入市场。
截至 2022 年 3 月 31 日,CDRH 和 CBER 已授予 657 项突破性器械的称号,包括最初在加速访问途径 (EAP) 计划下指定的器械。其中五个器械是由CDRH(生物制品评估和研究中心监管)的组合产品,而其他器械则由CBER(器械和放射健康中心)监管。
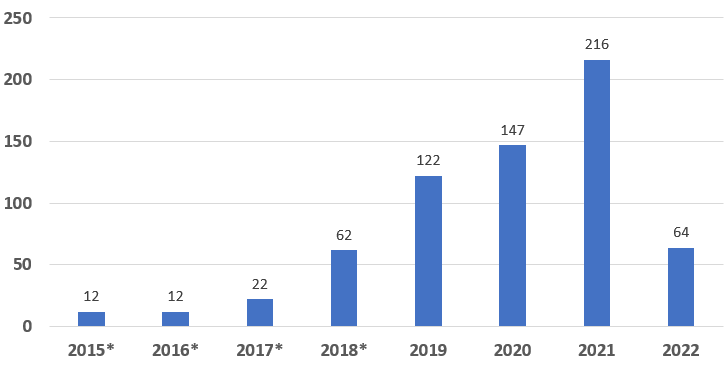
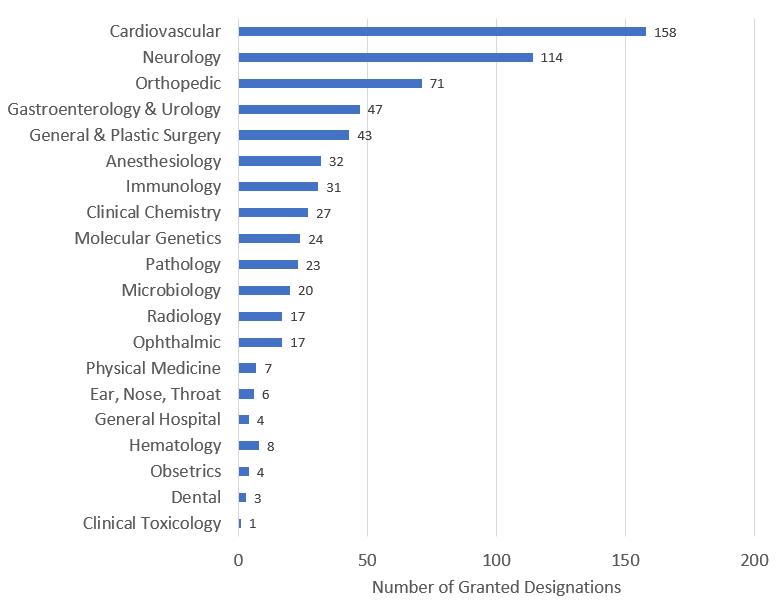
根据临床小组授予的突破性器械指定数量显示:心血管器械为 158 台。其次是神经科器械(114 台)和骨科器械(71 台)。
02什么是突破性器械计划?
突破性器械计划是针对某些医疗器械和以器械为主导的组合产品的自愿计划,旨在对威胁生命或不可逆转的衰弱疾病或状况提供更有效的治疗或诊断。
突破性器械计划的目标是通过加快开发、评估和审查,为患者和医疗保健提供者提供及时获得这些医疗器械的机会,同时保留上市前批准、510(k) 许可和 De Novo 上市许可,符合 FDA 保护和促进公众健康的使命。
突破性器械计划取代了医疗器械的加速访问途径和优先审查。FDA 认为根据快速获取途径获得指定的器械是突破性器械计划的一部分。
03如何满足申请条件?
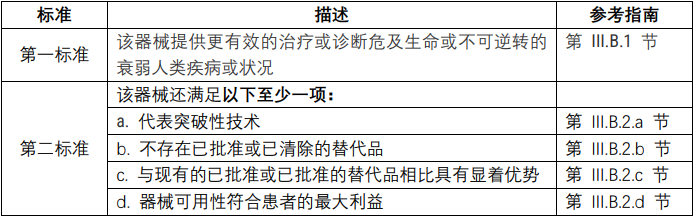
如果满足以下两个标准,则需要上市前批准申请 (PMA)、上市前通知 (510(k)) 或 De Novo 指定请求的器械有资格获得突破性器械指定:
04何时申请突破性器械称号?
您可以在发送营销提交之前随时为您的器械发送突破性指定请求(例如,上市前批准 (PMA)、上市前通知 (510(k)) 或从头分类请求)。



