欧盟UDI线上课程Q&A
2023年3月30日,洲通健康资深讲师给大家带来了《欧盟UDI介绍》线上课程。
课程干货满满,本次课程的讲师详细地介绍了欧盟UDI注册的各个流程以及疑难点。
课程最后,许多听众提出了UDI注册的相关问题,部分问题及回答整理如下:
Q:要录入数据库的产品是不是都是已上市的,没有销往欧洲的就不需要录入数据库?
A:录入数据库后,就相当于你已经在数据库完成注册备案,等以后你这个产品上市后就可以不再录入数据库,因为本身已经存在,但是当时录入的时候你选择的是未上市销售,需要改一下产品的状态。
是否录入未上市的产品,看企业自己的计划安排。录入数据库的目的是你上市销售的产品得再数据库中有注册备案。
Q:LUA账户注册时候权限没设置录入UDI,之后增加权限在哪操作?
A:用LAA账户删除LUA账号,重新给LUA账号进行注册,重新选择权限。
Q:MDR证书拿到前,在欧洲市场上销售的器械都是按照遗留器械的UDI-DI录入吗?
A:是的,也可以不注册遗留器械,因为没有强制要求。但有些你们自己的客户可能会有这个要求,所以就要按照遗留器械UDI-DI录入。
Q:Basic UDI-DI和UDI-DI只能手动一个一个录入吗?有批量上传的功能吗?具体如果有的话,需要怎么操作呢?
A:目前操作指南中没有提到批量录入,因为每个Basic UDI-DI 和UDI-DI的内容都是不一样的,代表产品型号也不一样,所以只能逐个选择。
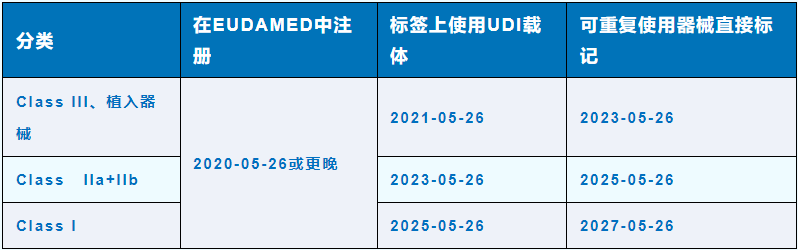
Q:不同类别的器械录入UDI的最后期限分别是什么时候?
A:
Q:IVDD遗留器械注册现在是强制性的吗?
A:没有强制要求,但有些企业的客户会需要,所以有这个需求。
Q:遗留器械没有UDI怎么办?
A:没有录入需求的,可以先不设置UDI,后期申请MDR,或客户有需求的,就需要编码UDI,并录入。
Q:遗留器械是只需要录入UDI-DI吗?不需要录入Basic UDI-DI吗?
A:对的,遗留器械EU EUDAMED 数据库会给你分配 EUDAMED DI。
Q:Basic UDI跟UDI-DI之间有什么区别?
A:Basic UDI-DI是器械类型的主要标识符。基本UDI-DI是在器械使用单位的层面上分配的DI。基本UDI-DI是在UDI数据库中记录的关键,也会在相关的证书、DOC、FSC、SSCP、技术文件中被引用。
UDI-DI: UDI - DI是一种数字或字母数字码,对于一种器械类型是唯一的,也被用作UDI数据库中所保存的信息的“访问密钥”。
Q:UDI-DI国内已录入,国外还要录入吗?
A:国内和国外不一样,数据库也不一样。不能等同。
Q:录入UDI时的某些选项的概念:欧盟检测证书是指?临床研究是指?PI是不是只需选择企业自定的类型?
A:欧盟检测证书:指的是MDR证书或MDD证书
临床研究:指的是产品是否有做相关的上市前临床研究、临床研究的对应编号等等,不是我们平时技术文档中写的临床评价报告。
PI:对根据企业自定类型。
Q:如果有一款产品,在一个规格型号里有多个组成部分,包括无菌和多次重复使用部分,这样应该怎么分布UDI-DI?
A:单个组件给它对应的本体UDI-DI。这些组件对应一个初包装的UDI-DI。



