临床调查报告指导文件
2023年5月8日,欧盟官方公报发布了关于临床调查报告摘要内容和结构的委员会指南。本指南旨在确保临床调查报告的摘要以医疗器械预期用户易于理解的方式和格式提供有关临床调查的设计、实施、分析和结果的信息。
根据 MDR Article 77(5),临床调查的申办者应在临床调查结束后一年内或提前终止后三个月内提交临床调查报告,该报告应附有摘要。附录XV第三章第7节概述了临床调查报告的最低要求以及摘要需涵盖的内容,即:
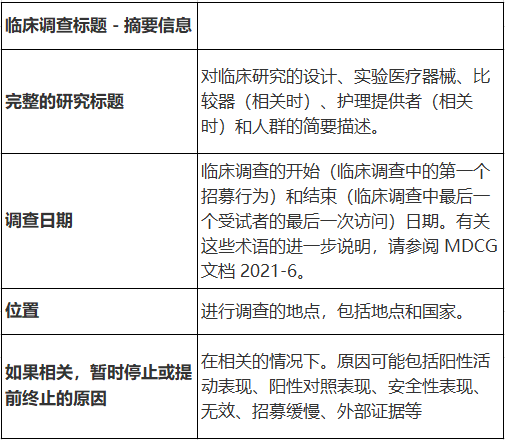
· 临床调查的标题
· 临床调查的目的
· 描述调查,研究设计和使用的方法
· 调查结果
· 调查结论
根据 MDR Article 77(5),报告和摘要应通过 MDR Article 73 所述的电子系统提交给进行临床调查的成员国。根据 MDR Article 77(7),报告和摘要最迟应在器械根据 MDR Article 73 注册时,在投放市场之前,通过MDR Article 29 所述的电子系统向公众开放。在提前终止或暂时停止的情况下,摘要和报告应在提交后立即向公众开放。
临床调查报告摘要
委员会指南提出了临床调查报告应遵循的结构,整体结构如下:
· 封面,包括标识详细信息
· 临床调查报告摘要的内容和结构,包括日期和地点等。特别是,本节必须包括:
- 临床调查的目的
- 研究设备、临床调查和所用方法的描述
- 调查结果
- 临床调查结论
· 修订条款
· 词汇表和缩略语
· 引用
部分临床调查报告具体要求内容如下:
2.1 封面页
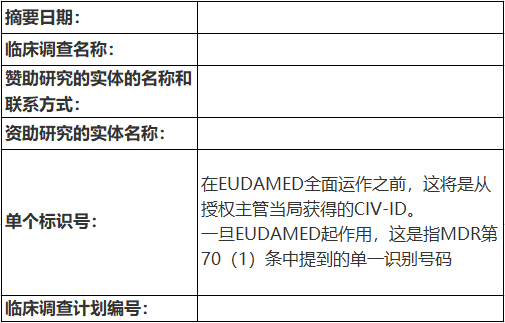
2.2临床调查报告摘要的内容和结构