MDCG 2020-3 重大变更指南
2023年5月12日,欧盟发布了MDCG 2020-3 Rev.1:MDR Article 120下MDD或AIMDD证书所涵盖器械的过渡条款的重大变更指南文件。
欧盟委员会对整个文件进行调整,以使其符合法规(EU)2023/607和指南MDCG 2022-2,旨在澄清MDR Article 120(3c)(b)点下“设计和预期用途的重大变化”的概念,帮助制造商和公告机构清楚地了解哪些设计或预期用途的更改将被视为“重大变更”。
重大变更详细内容
设计或预期目的的重大变更由两个累积因素组成:
设计或预期用途发生变化
该变化是重大变化
这意味着不涉及设计或预期目的的变更不在MDR Article 120(3c)的范围内。同样,涉及设计或预期目的的变更只有在被认为是“重大”的情况下才属于MDR Article 120(3c)的范围。
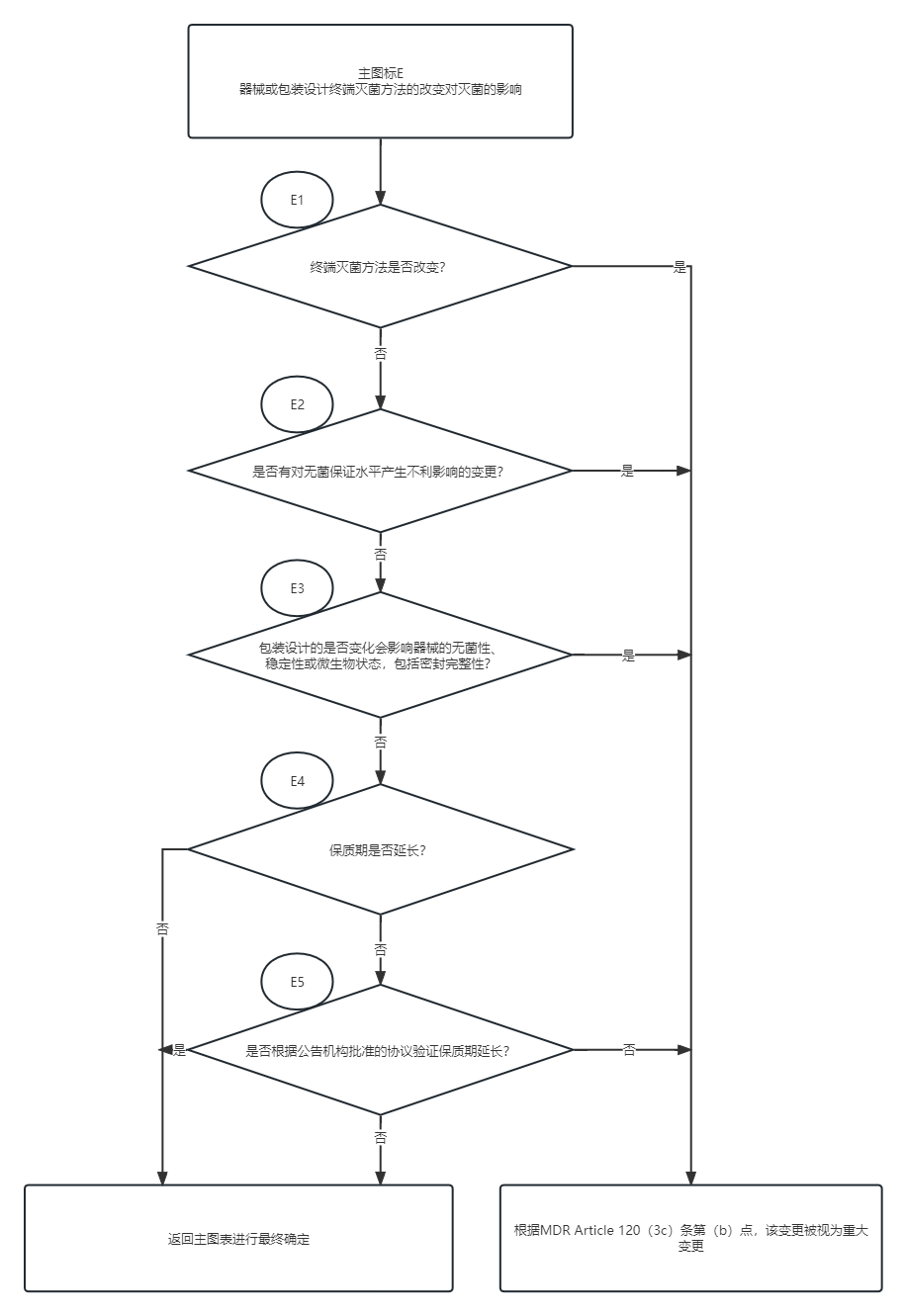
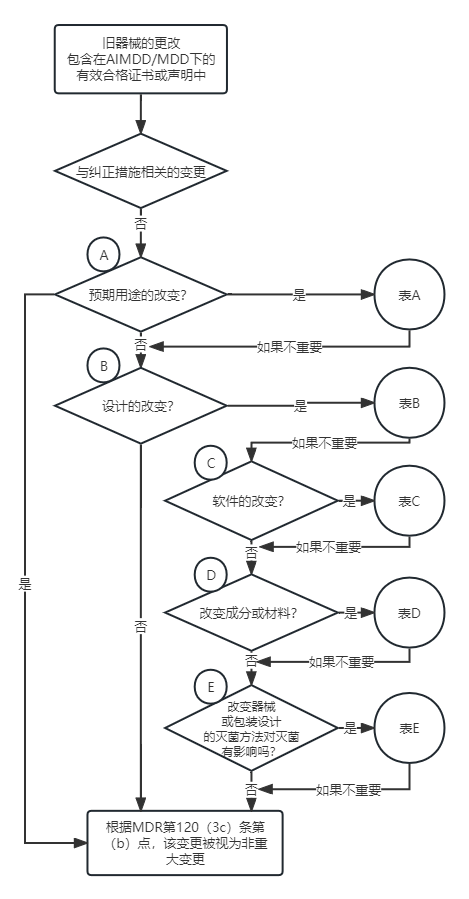
判断器械变更是否属于重大变更,可参考下方流程图:
主图表
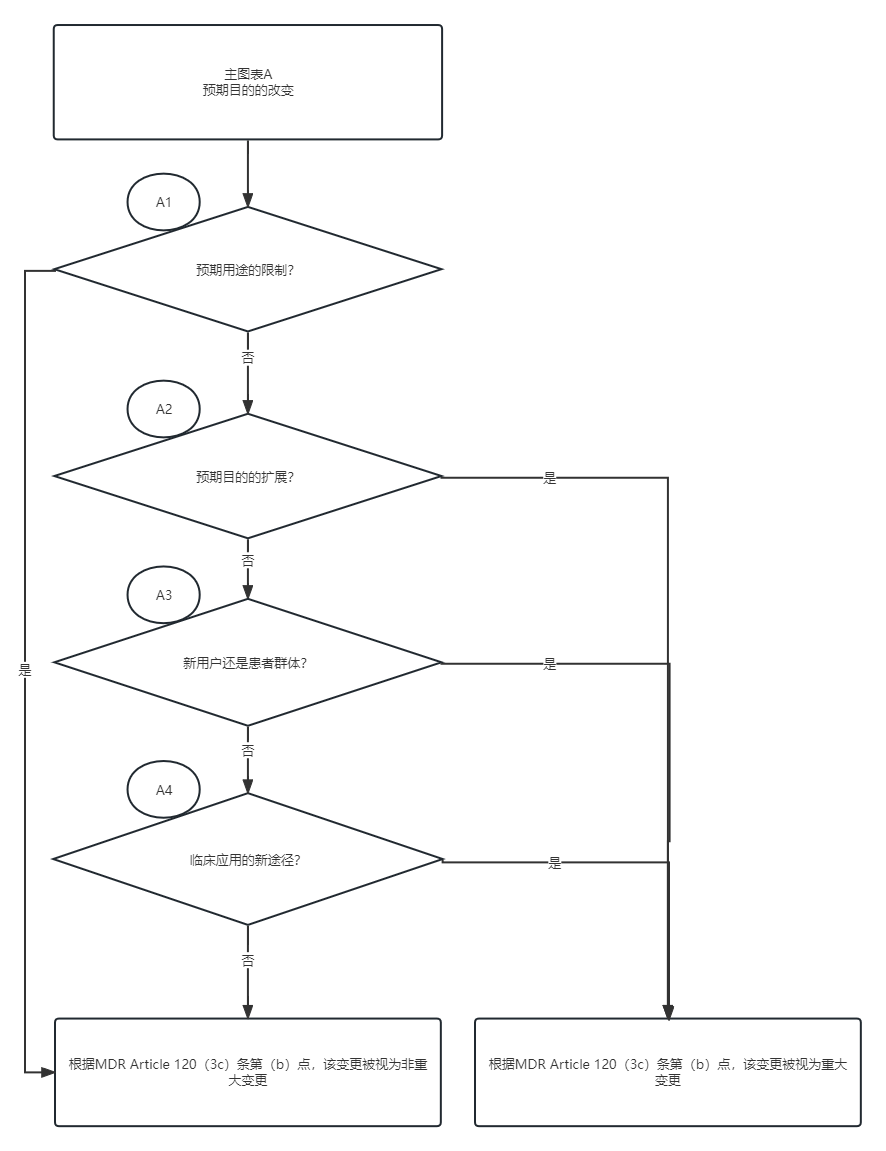
图表A:预期用途变更
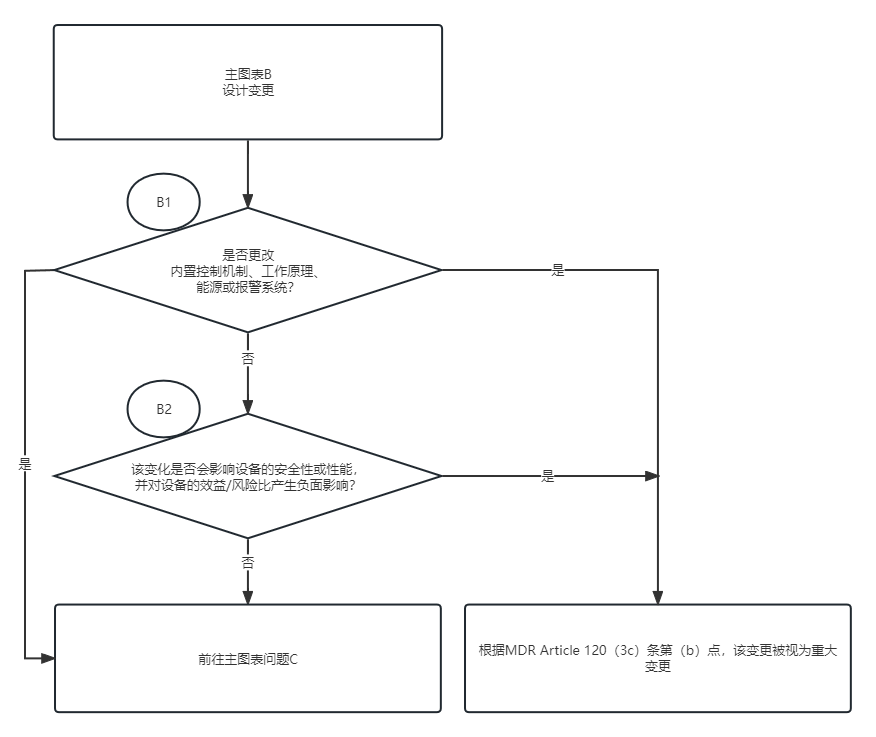
图表B:设计变更
图表C:软件变更

图表D:物质或材料的变更

图表E:器械或包装设计终端灭菌方法的改变对灭菌的影响