MDCG 2024-4 临床试验计划内容指南
当地时间2024年3月12日,欧盟发布了MDCG 2024-4 临床试验计划内容指南。

该指南旨在支持制造商制定其临床试验计划CIP而编写的,通过更详细地描述在相应的CIP部分中预期的信息类型,以避免在评估临床试验申请时出现来自主管部门提出的问题。此外,具有适当内容的CIP将有助于进行临床试验。
临床试验计划CIP的目的
临床试验计划(CIP)应规定临床试验的基本原理、目标、设计方法、监测、实施、记录保存和分析方法。CIP应足够详细,作为研究人员在试验地点和时间内以一致的方式进行临床试验的手册。
此外,CIP应允许主管当局和伦理委员会评估临床试验的设计方式,在风险最小化后权衡预期的临床益处时,是否证明了对受试者或第三方的潜在风险是合理的。CIP还应允许评估临床试验中产生的数据的可靠性和稳定性是否保证受试者接触CIP中描述的试验器械和程序。
CIP还应允许评估临床试验中是否保证受试者暴露于CIP中所述的试验器械和程序时产生的数据的可靠性和稳定性。
临床试验计划CIP所应涵盖的内容
需要注意的是,最好将所有必要的信息都包括在CIP中。如所需资料的一部分以另一份文件提供,则需在CIP内作摘要及引用。参考文件必须与CIP一起提交,作为临床试验申请所附的初始提交文件包的一部分。
临床试验计划CIP所需内容的简要概述如下:
1. 一般内容
包括临床试验的标题、CIP编号(如制造商唯一标识符、CIV-ID、SIN等)、CIP的版本和日期、修改时的修订历史摘要、缩写和缩略词、临床试验的总体概要等。
2. 试验器械的标识和说明
CIP的这一部分应包括试验器械的概述、试验器械制造商的详细信息、型号/类型的名称或编号、试验器械的详细说明等。如适用,可参考试验者手册(IB)和/或使用说明书(IFU)。在使用对比器械的情况下,还应为对比器械提供信息。
3. 试验器械、临床程序和临床试验的益处和风险
应说明拟议临床试验的潜在益处,识别参与临床试验将导致受试者暴露的所有风险,并考虑到MDR第62(3)条和第62(4)e条规定的条件,总结临床试验的收益风险比的基本原理。
4. 临床试验的相关性
描述临床试验与临床实践最新进展的相关性。
5. 目标和假设
应说明临床试验的目的、待验证的试验器械的临床性能、有效性或安全性声明。
6. 临床试验的设计
设计应足够详细,并有证据证明其科学稳定性和有效性。
7. 统计设计和分析
CIP应描述和证明临床试验的统计设计和分析。
8. 数据管理
在临床试验计划中,应提供所实施程序的描述,以确保临床试验中产生的数据是可靠和稳定的。
9. CIP的修改
从临床试验计划中可以清楚地看出,应根据MDR Article 75的要求,将所有可能对受试者的安全健康或权利或试验产生的临床数据的稳定性或可靠性产生重大影响的已批准临床试验的拟议变更通知主管当局。
此外,CIP应通知试验者,在实施变更之前,需要等待MDR Article 75规定的时间或等待实质性修改的批准,以先到者为准。
10. 与CIP的偏差
应当有一份声明,规定试验者不得偏离CIP,除非是为了在紧急情况下保护人类受试者的权利、安全和福祉,否则试验者可能会在未经申办者事先批准的情况下偏离CIP。
还需要在CIP中明确说明,不允许放弃CIP应描述CIP偏差的记录、报告和分析程序,包括通知要求和时间框架。此外,还应包括纠正和预防措施以及主要试验者不合格标准。
11. 器械责任
应在CIP中纳入试验器械的问责和可追溯性的适当程序,特别是对器械的访问和适当存储的控制与临床试验中使用的器械相关的随访,以及未使用、过期或故障器械的归还。
12. 合规声明
应包含”说明遵守国家立法和MDR的声明“在内的诸多声明。
13. 知情同意程序
描述获得知情同意书的一般流程,包括向受试者提供新信息的流程,以及根据需要对受试者参与临床试验进行补偿的流程。如果适用,还必须包括受试者无法给予知情同意的情况下的过程描述。
14. 不良事件、不良器械影响和器械缺陷
列出不良事件(AE)、器械不良反应(ADE)、器械缺陷(DD)、严重不良事件(SAE)和严重器械不良反应的定义。注意MDR Article 80中对不良事件记录和报告的要求,并参考指导文件MDCG 2020-10/1了解SAE和DD报告的定义和更多信息。
必须列出可预见的不良事件和预期的不良器械影响列表,以及它们可能发生、缓解或治疗的概率。
15. 临床试验结束、暂停或提前终止
如MDR Article 77所述,试验结束定义对于试验结束时的报告要求非常重要。临床试验计划应考虑受试者和试验水平的适当停止标准。
16. 参与临床试验后的护理安排
描述受试者参与临床试验结束后的护理安排,这些额外的护理是因为受试者参与临床试验而必须的,并且不同于通常对所讨论的医疗状况的预期。
17. 出版政策
需包含以下声明:
临床试验将在公开数据库中注册的声明
表明临床试验结果将公开的声明
说明临床试验结果发表的条件和时间框架的声明,包括申办者的角色和作者标准
18. 器械的技术和功能特点
列出器械的技术和功能特征,并说明临床试验中试验的特征。
19. 参考文献
与临床试验相关的参考文献列表。
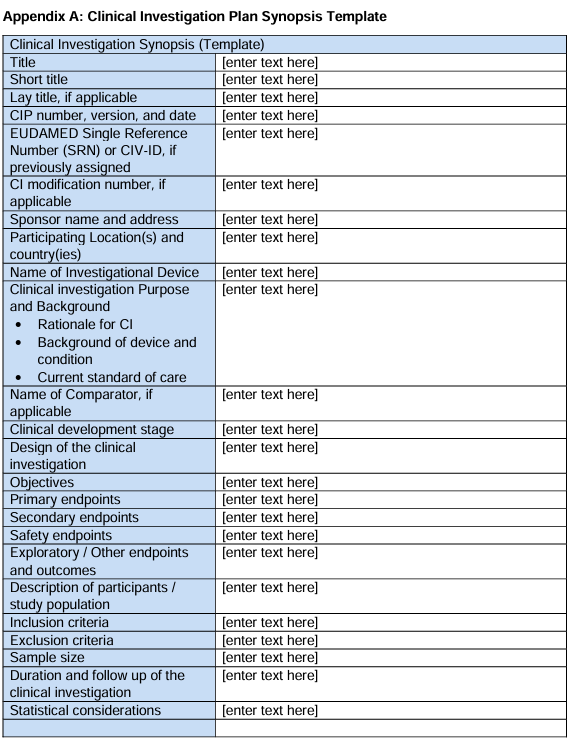
在指导文件的最后,MDCG小组还提供了一份临床试验计划概要模板供制造商参考,具体如下: